
Dra. Adriana Maria Alves De Tommaso
Dr. Stéfano Gonçalves Jorge
INTRODUÇÃO
O fígado é a maior víscera sólida do corpo humano, com peso médio de 1,2 a 1,5 kg em adultos, correspondendo a 2–3% do peso corporal. Em recém-nascidos, essa proporção é ainda maior, chegando a 5%. Situado no hipocôndrio direito e epigástrio, logo abaixo do diafragma, exerce funções vitais relacionadas ao metabolismo, digestão, defesa imunológica e homeostase. É, essencialmente, uma massa de células permeada por um complexo mas organizado sistema de canais que transportam o suprimento sanguíneo e a bile. Recebe 25-30% do débito cardíaco. Está recoberto pela cápsula de Glisson, uma fina membrana fibrosa que se estende pelos espaços porta, envolvendo vasos e ductos.
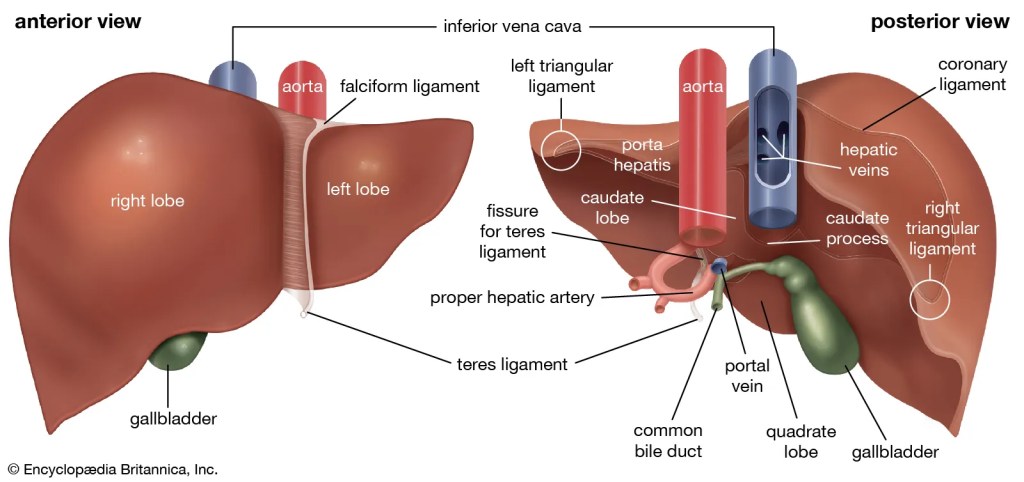
ANATOMIA MACROSCÓPICA
Lobos e Segmentos
- O fígado apresenta divisões anatômicas (lobos direito e esquerdo, separados pelo ligamento falciforme), cirúrgicas (onde a divisão de lobos é divisão é feita ao nível do porta-hepatis – local onde a artéria hepática e a veia porta se dividem em ramos diretais e esquerdo) e funcionais, mais relevantes clinicamente.
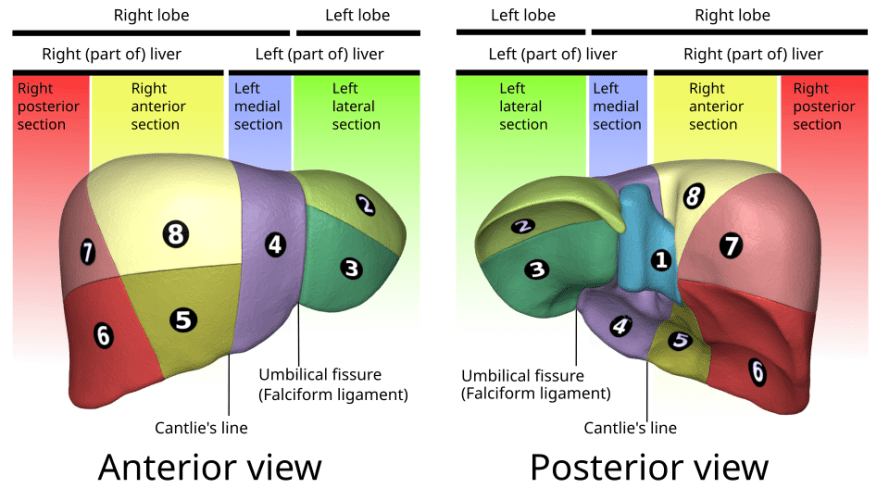
- A divisão funcional segue o sistema de Couinaud, que organiza o parênquima em oito segmentos independentes, cada um com seu pedículo portal próprio e drenagem venosa específica.
- Essa segmentação é fundamental em ressecções hepáticas e transplante, pois permite retirar áreas doentes preservando parênquima viável.
Relações Anatômicas
- Superiormente: diafragma e pulmões.
- Anteriormente: parede abdominal, costelas, cartilagens costais e estômago.
- Inferiormente: cólon transverso, duodeno, vesícula biliar e rim direito.
- Posteriormente: veia cava inferior, glândula suprarrenal direita e esôfago abdominal.

Vascularização
O fígado é nutrido por uma circulação dupla, ao contrário da maioria dos órgãos. A veia porta é responsável por 70 a 80% do sangue que passa pelo fígado, e a artéria hepática 20 a 30%. Essa circulação dupla é herança evolutiva dos anfíbios e répteis (leia sobre a evolução do fígado). Pela veia porta chega ao fígado todo material absorvido nos intestinos, com exceção de parte dos lipídios (transportada por via linfática). Graças a essa característica, ele se encontra em posição privilegiada para metabolizar e acumular nutrientes e neutralizar e eliminar substâncias tóxicas absorvidas.

A veia porta é formada pela junção da veia mesentérica superior e veia esplênica e se dirige para o lobo D a medida que se aproxima do porta-hepatis. Ramifica-se num tronco curto D (lobo superior D, área à direita da vesícula, porção ântero-superior do fígado) e num tronco E mais longo (região lateral do lobo E, lobos quadrado e caudado). Cada ramo terminal tem um território nitidamente definido. A artéria hepática e seus ramos são bem menos constantes. Em 55% das pessoas ela se origina diretamente da artéria celíaca mas, no restante, pode se originar da mesentérica superior, gastroduodenal, gástrica D ou E ou até mesmo da aorta. Dentro do fígado, seguem os ramos da veia porta. A maior parte do fluxo vai para o estroma, ductos biliares e vesícula biliar. As veias hepáticas são retas e drenam posteriormente para a veia cava posterior (a D drena o lobo superior D, a E drena o lobo E e a intermediária drena a área suprida pelas ramos D e E da veia porta). Variações anatômicas são comuns: até 40% da população apresenta anomalias vasculares (artérias acessórias, veias hepáticas adicionais). Isso é crítico em transplante e cirurgia oncológica.
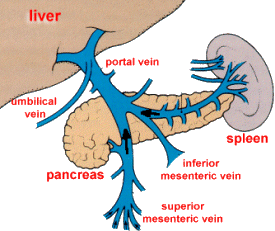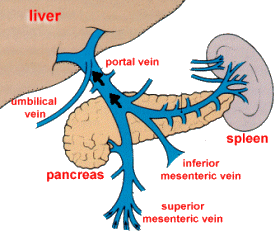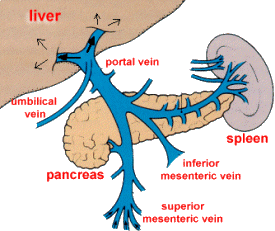
Sistema Biliar
- A bile é produzida nos canalículos biliares entre hepatócitos → ductos de Hering → ductos interlobulares → ductos hepáticos direito e esquerdo → ducto hepático comum.
- O ducto colédoco é formado pela junção do ducto hepático comum e ducto cístico, desembocando na papila duodenal maior.
- A bile contém sais biliares, colesterol, fosfolipídios e bilirrubina, essenciais para digestão de lipídios e eliminação de metabólitos.

Drenagem Linfática
O fígado possui uma rede linfática complexa, de importância clínica fundamental tanto em condições fisiológicas como patológicas. Estima-se que ele seja responsável por até 25–50% da linfa torácica, volume que pode aumentar consideravelmente em casos de cirrose com hipertensão portal.
A drenagem linfática hepática pode ser subdividida em três sistemas principais:
- Sistema portal – capilares linfáticos acompanham os elementos da tríade portal (veia porta, artéria hepática e ducto biliar), formando vasos coletores que convergem para linfonodos do hilo hepático e do pequeno omento. A partir desses, os vasos eferentes seguem para os linfonodos celíacos e, posteriormente, para a cisterna do quilo, origem do ducto torácico, que desemboca na veia subclávia esquerda.
- Sistema perivenular – vasos linfáticos associados às veias centrolobulares e hepáticas convergem em troncos linfáticos maiores que acompanham a veia cava inferior, atravessando o diafragma em direção aos linfonodos mediastinais.
- Sistema subcapsular – a linfa da superfície convexa do fígado drena pelos ligamentos coronário e triangular em direção a linfonodos mediastinais, enquanto a da superfície côncava segue para linfonodos do hilo e linfonodos regionais.

Esse arranjo anatômico explica porque doenças hepáticas podem se manifestar com linfonodomegalias abdominais ou mediastinais, bem como a importância da avaliação dos linfonodos regionais na oncologia hepática e biliar. Na hipertensão portal, por exemplo, a linfangiogênese hepática contribui para ascite refratária.
Inervação Hepática
O fígado recebe fibras do sistema nervoso autônomo, com papéis regulatórios sobre fluxo sanguíneo, secreção biliar e respostas imunológicas:
- Simpática: origina-se dos segmentos torácicos T7–T10 e chega ao fígado pelo plexo celíaco. Essas fibras modulam o tônus vascular e contribuem para respostas de vasoconstrição e regulação do fluxo portal.
- Parassimpática: chega através dos ramos do nervo vago (X par craniano), estimulando funções metabólicas e secretórias, incluindo o aumento do fluxo biliar e participação na regulação glicêmica.
- Fibras sensoriais: acompanham o trajeto das fibras autonômicas. Apesar de o fígado ser relativamente “silencioso” em termos de dor, a distensão da cápsula de Glisson (por exemplo, em hepatomegalia congestiva ou tumoral) pode gerar dor referida no hipocôndrio direito ou até mesmo irradiada para ombro direito (via nervo frênico).
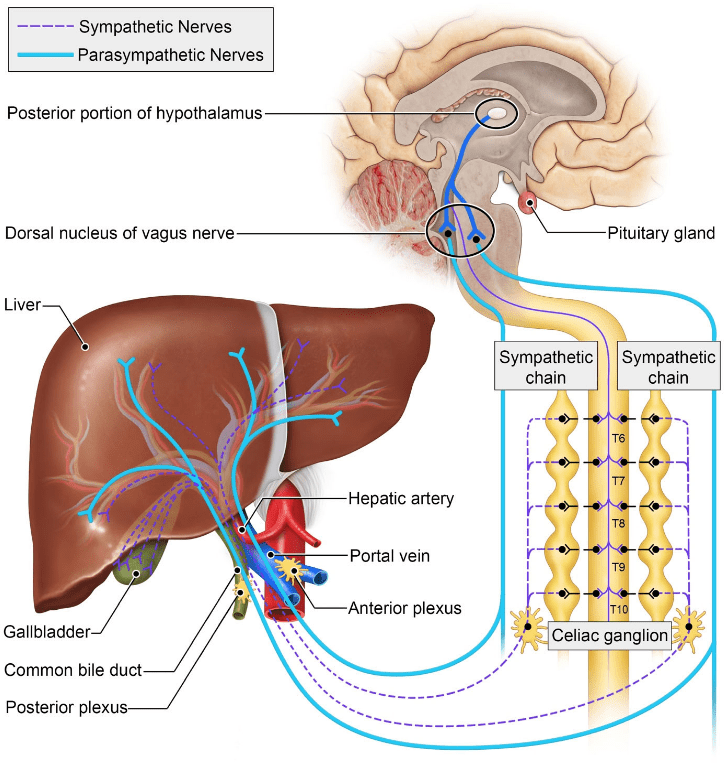
A compreensão dessas vias tem implicações clínicas relevantes: a modulação autonômica hepática é alvo de estudos sobre neuroimunomodulação, especialmente no contexto de inflamação crônica e fibrose.
AVALIAÇÃO CLÍNICA
- Inspeção: geralmente é de pouco valor diagnóstico. Quando há importante hepatomegalia ou grandes nódulos pode-se visualizar à inspeção.
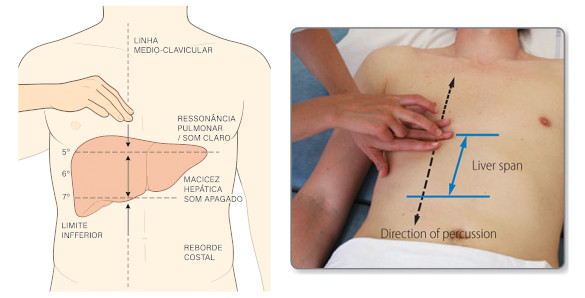
- Palpação e percussão: no recém nascido, o lobo esquerdo é maior do que o direito. Por volta de 1 ano de idade os lobos são de tamanho semelhante e em crianças acima de 1 ano o padrão passa a ser o do adulto (dirreito maior que o esquerdo). O fato de o fígado ser palpável não implica, necessariamente, presença de hepatomegalia. Para avaliar melhor a presença de hepatomegalia é necessário fazer a hepatimetria pois, em algumas ocasiões (ex.: derrame pleural, ) o fígado está apenas rebaixado. Também podemos obter alguma informação sobre a natureza da doença hepática através da palpação. A borda normal é algo afilada e de consistência macia e a superfície normal é lisa. A percussão tem grande importância em detectar o tamanho do fígado, sendo capaz de detectar a redução de seu tamanho (por exemplo, na cirrose hepática).
- Ausculta: de valor na detecção de fluxo sanguíneo hepático aumentado em lesões vasculares tais como tumores e hemangiomas. Um sopro arterial sobre o fígado pode indicar câncer ou hepatite alcóolica aguda. O sopro venoso da hipertensão porta pode ser audível entre o apêndice xifóide e o umbigo.
HISTOLOGIA
O fígado é constituído principalmente por hepatócitos, células poliédricas com 20–30 μm de diâmetro, que representam cerca de 70–80% da população celular hepática. Esses hepatócitos se organizam em placas celulares anastomosadas, que delimitam unidades morfológicas denominadas lóbulos hepáticos. Cada lóbulo é uma estrutura poliédrica com cerca de 0,7 por 2 mm, na qual os hepatócitos estão dispostos radialmente a partir de uma veia centrolobular, em placas geralmente formadas por uma única camada de células.
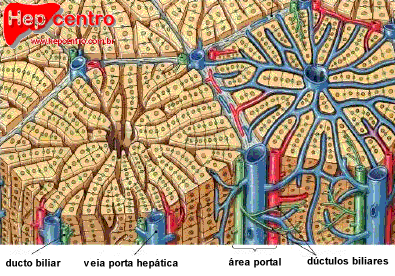
Os lóbulos são justapostos, mas em seus ângulos encontram-se regiões de tecido conjuntivo especializado chamadas espaços-porta. Cada espaço-porta contém uma vênula porta (ramo da veia porta), uma arteríola (ramo da artéria hepática), um ducto biliar interlobular, vasos linfáticos e fibras nervosas. Esse conjunto, circundado pela placa limitante (continuação da cápsula de Glisson), constitui a chamada tríade portal.
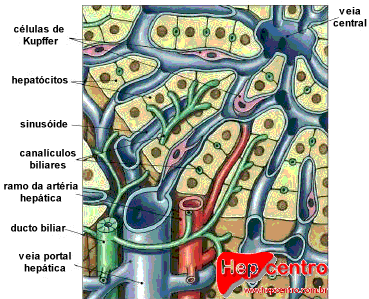
Do espaço-porta, o sangue flui através de canais regulados por pequenos esfíncteres em direção a uma rede de capilares denominados sinusoides hepáticos. Estes preenchem os espaços entre as placas de hepatócitos e apresentam revestimento endotelial fenestrado. Entre suas células encontram-se os macrófagos residentes, denominados células de Kupffer, com função fagocitária e participação no sistema imunológico inato. Entre o endotélio sinusoidal e os hepatócitos existe o espaço de Disse, rico em fibras reticulares, onde ocorrem intensas trocas metabólicas. Nesse espaço também residem as células estreladas hepáticas (células de Ito ou HSC), responsáveis pelo armazenamento de vitamina A em vacúolos lipídicos e que, quando ativadas em processos crônicos, tornam-se produtoras de colágeno, desempenhando papel central na fibrogênese e na cirrose (Gressner et al., 2007).
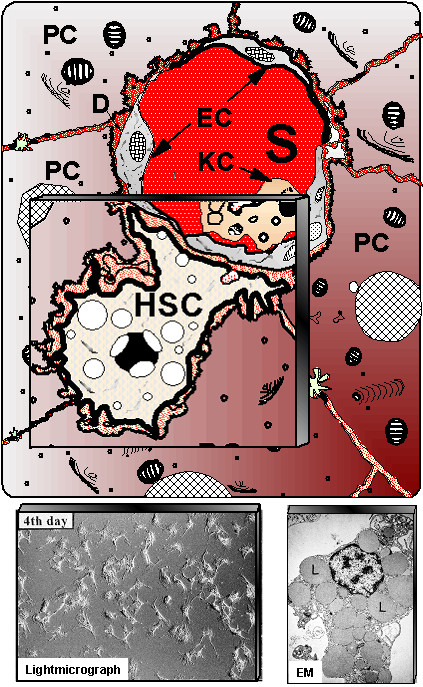
S – sinusoides hepáticos; KC – células de Kupffer.
No canto inferior esquerdo, HSC cultivadas em microscopia de luz; no canto inferior direito, microscopia eletrônica (ME) mostrando numerosas vacúolas lipídicas (L) em uma HSC, onde são armazenados os retinoides.
Gressner et al. Comparative Hepatology 2007; 6:7. doi:10.1186/1476-5926-6-7
Os sinusoides convergem para a veia centrolobular, que drena para veias sublobulares e, posteriormente, para as veias hepáticas. Como o sangue percorre os sinusoides da periferia para o centro do lóbulo, estabelece-se um gradiente metabólico: os hepatócitos periportais (zona 1) recebem sangue mais oxigenado e rico em nutrientes, enquanto os hepatócitos centrolobulares (zona 3) recebem sangue mais pobre em oxigênio, mas são mais ativos em reações de biotransformação mediadas pelo sistema do citocromo P450. Essa distribuição explica padrões distintos de lesão: hepatite viral tende a acometer a zona periportal, enquanto necroses tóxicas e hipóxicas predominam na zona centrolobular.
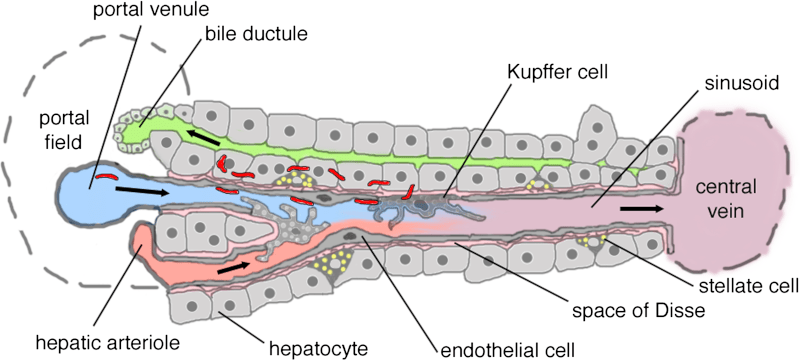
Além do espaço de Disse, entre hepatócitos também se encontram os canalículos biliares, que não possuem parede própria. Eles constituem a primeira via coletora da bile, fluindo do centro do lóbulo em direção à periferia, onde desembocam nos ductos de Hering. Estes se unem para formar ductos biliares progressivamente maiores até constituírem os ductos hepáticos. A análise histológica do número de ductos biliares por espaço-porta tem importância diagnóstica: o índice normal é >0,4 (0,9–1,8 em crianças), e valores <0,4 sugerem hipoplasia ductal.
Ácino Hepático
O ácino hepático é considerado a unidade funcional do fígado, pois reflete melhor a organização do suprimento sanguíneo. Os hepatócitos são dispostos em zonas concêntricas ao redor dos vasos portais terminais:
- Zona 1 (periportal): primeira a receber sangue, rica em oxigênio, insulina e glucagon. Tem alta atividade metabólica, é mais resistente à hipóxia, mas mais exposta a toxinas absorvidas.
- Zona 2 (mediolobular): recebe sangue com composição intermediária.
- Zona 3 (centrilobular): última a receber sangue, mais suscetível à hipóxia e necrose, porém rica em enzimas de biotransformação (citocromo P450).
Microscopia Eletrônica
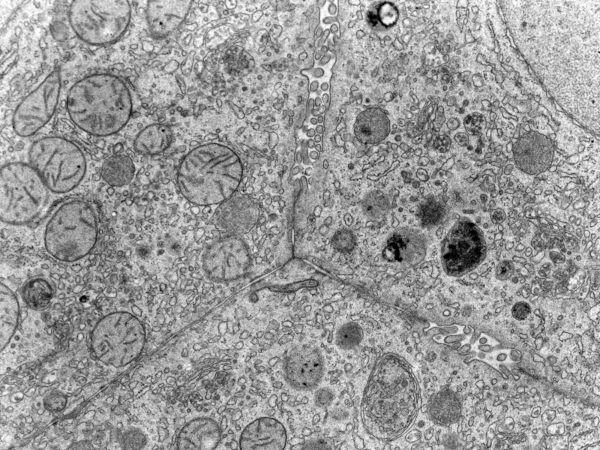
Ao microscópio eletrônico, destaca-se o retículo endoplasmático rugoso (RER), onde ocorre a síntese de proteínas plasmáticas como albumina, protrombina e fibrinogênio. O retículo endoplasmático liso (REL) é responsável por metabolismo de lipídeos, detoxificação e síntese de esteroides. O glicogênio, visível como grânulos citoplasmáticos, funciona como reserva energética variável conforme o estado metabólico.
Colorações Histológicas Especiais
- Hematoxilina-eosina (HE): coloração de rotina.
- Tricrômico de Masson: evidencia colágeno em azul (fibrose).
- Sais de prata: evidenciam fibras reticulínicas.
- Azul da Prússia de Perls: identifica ferro (coloração azul-esverdeada).
- Rodanina: identifica depósitos de cobre.
- PAS (Periodic Acid–Schiff): cora glicogênio e depósitos protéicos; com diástase, diferencia glicogênio (removido) de inclusões resistentes, como na deficiência de alfa-1 antitripsina.
BIBLIOGRAFIA
- Standring S. Gray’s Anatomy: The Anatomical Basis of Clinical Practice. 42nd ed. Elsevier; 2020.
- Moore KL, Dalley AF, Agur AMR. Clinically Oriented Anatomy. 8th ed. Wolters Kluwer; 2018.
- Sherlock S, Dooley J. Diseases of the Liver and Biliary System. 14th ed. Wiley-Blackwell; 2018.
- Netter FH. Atlas de Anatomia Humana. 7ª ed. Elsevier; 2019.
- Palmer BW, Lalani E, Polak WG, et al. Segmental anatomy of the liver: surgical relevance. J Hepatobiliary Pancreat Sci. 2021;28(4):345-356.
- Michalopoulos GK. Hepatocytes: functional anatomy of the liver. Compr Physiol. 2013;3(1):113-126.
- Zheng Y, Zhang H, Jia J. Hepatic microcirculation and sinusoidal remodeling. Liver Int. 2022;42(9):2091-2104.
- Brunt EM. Nonalcoholic steatohepatitis: pathology and mechanisms. Semin Liver Dis. 2013;33(1):3-13.
- Schnatterer B, Bechmann LP, Götze O, et al. Kupffer cells and sinusoidal endothelial cells in disease. Front Med. 2020;7:107.
- Prin, Meghan & Bakker, Jan & Wagener, Gebhard. (2015). Hepatosplanchnic circulation in cirrhosis and sepsis. World journal of gastroenterology : WJG. 21. 2582-2592. 10.3748/wjg.v21.i9.2582.
- Tanaka M, Iwakiri Y. The Hepatic Lymphatic Vascular System: Structure, Function, Markers, and Lymphangiogenesis. Cell Mol Gastroenterol Hepatol. 2016 Sep 14;2(6):733-749. doi: 10.1016/j.jcmgh.2016.09.002. PMID: 28105461; PMCID: PMC5240041.
- Mandal, Santosh & Yadav, Poonam & Sheth, Rahul. (2024). The Neuroimmune Axis and Its Therapeutic Potential for Primary Liver Cancer. International Journal of Molecular Sciences. 25. 6237. 10.3390/ijms25116237.
Artigo criado em: 2003
Última revisão: 29/09/25

