
INTRODUÇÃO
A peritonite bacteriana espontânea (PBE) é uma das complicações mais graves da cirrose hepática com ascite e constitui uma emergência hepatológica. Trata-se de uma infecção do líquido de ascite na ausência de uma causa intra-abdominal evidente (como perfuração intestinal, abscesso ou cirurgia recente) e ocorre tipicamente em pacientes com insuficiência hepática e hipertensão portal.
DEFINIÇÃO
Segundo a diretriz de 2021 da American Association for the Study of Liver Diseases (AASLD), define-se PBE como infecção do líquido de ascite, em paciente com cirrose e ascite, sem fonte intra-abdominal evidente. Os critérios diagnósticos habituais são: contagem de neutrófilos (polimorfonucleares, PMN) no líquido de ascite ≥ 250 células/mm³ ou cultura positiva do líquido mesmo se PMN < 250, desde que não haja outro foco evidente de peritonite secundária. A diretriz da associação europeia (EASL) (2010) define de modo semelhante, incluindo a distinção entre PBE típica, variáveis como “neutrofílica sem cultura positiva”.
| Variantes da infecção no líquido ascítico | |
| Peritonite bacteriana espontânea | PMN ≥ 250 células/mm3 e cultura positiva |
| Bacteriascite | PMN < 250 células/mm3 e cultura positiva |
| Ascite neutrofílica | PMN ≥ 250 células/mm3 e cultura negativa |
| Peritonite bacteriana secundária | PMN ≥ 250 células/mm3 e cultura positiva (polimicrobiana), glicose baixa, LDH elevada e achados em exame de imagem |
Uma das possíveis complicações da cirrose é o acúmulo de líquido no abdome, chamado popularmente de “barriga d´água” (ascite). Esse líquido pode ser infectado por bactérias (peritonite), sem que haja uma ferida ou cirurgia visível como causa — ou seja, “espontânea”. LEIA MAIS SOBRE ASCITE.
FISIOPATOLOGIA
A PBE é uma manifestação da profunda disfunção imunológica e hemodinâmica observada na cirrose hepática descompensada com ascite. Sua fisiopatologia resulta da interação de quatro mecanismos centrais e interdependentes: disbiose intestinal, aumento da permeabilidade da mucosa, translocação bacteriana e deficiências na imunidade inata e adaptativa, tanto locais quanto sistêmicas.
Disbiose intestinal e proliferação bacteriana
A cirrose altera profundamente o microbioma intestinal, reduzindo a diversidade bacteriana e favorecendo o crescimento de espécies pró-inflamatórias, como Enterobacteriaceae, Streptococcus e Enterococcus spp. (Albillos et al., J Hepatol 2020). Essa disbiose decorre de múltiplos fatores:
- redução do fluxo biliar e de ácidos biliares antimicrobianos,
- aumento do pH intestinal,
- atraso no trânsito intestinal e uso de inibidores de bomba de prótons,
- má nutrição e desnutrição proteica.
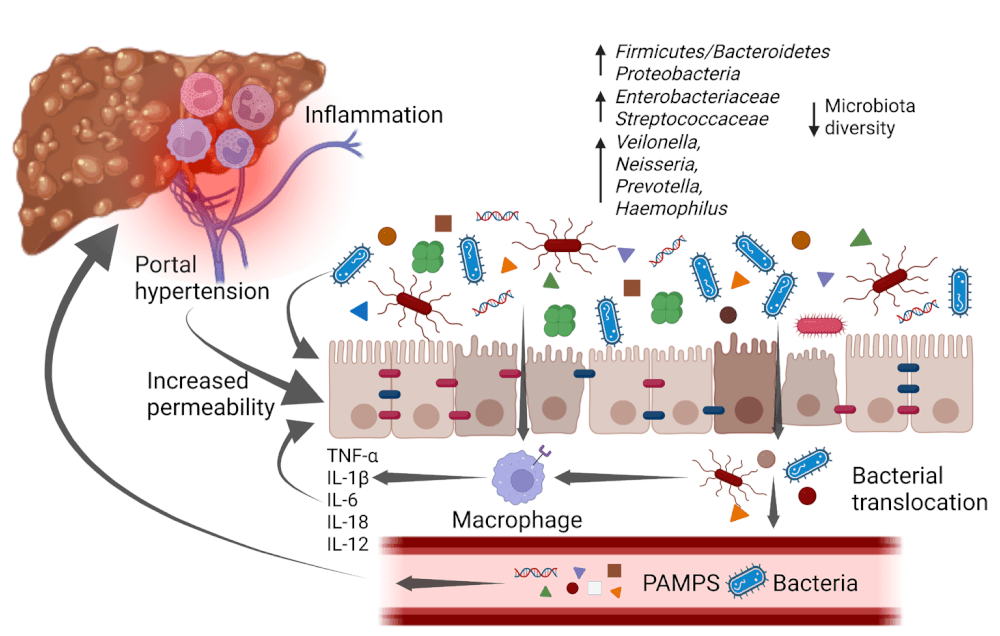
Essas mudanças levam a uma microbiota com maior potencial inflamatório e aumentada produção de lipopolissacarídeos (LPS) e padrões moleculares associados a patógenos (PAMPs).
Alteração da barreira intestinal
A hipertensão portal e a inflamação intestinal provocam edema da mucosa e remodelação das junções epiteliais. Isso resulta em uma barreira intestinal “permeável” — condição conhecida como leaky gut. Nesse contexto, as bactérias e seus produtos (LPS, DNA bacteriano, peptidoglicanos) podem atravessar o epitélio e alcançar os linfonodos mesentéricos, a circulação portal e, finalmente, o líquido de ascite. A hipertensão portal desempenha papel central, promovendo congestão da microcirculação intestinal, hipóxia da mucosa e liberação de mediadores pró-inflamatórios (TNF-α, IL-6, IL-1β), que amplificam a disfunção da barreira. (Wiest & Garcia-Tsao, J Hepatol 2005)
Translocação bacteriana e ativação imune
O termo translocação bacteriana (TB) refere-se à passagem de bactérias viáveis ou de seus produtos antigênicos do lúmen intestinal para locais estéreis, como linfonodos mesentéricos e líquido ascítico.
Três fatores são determinantes para a TB na cirrose:
- Supercrescimento bacteriano intestinal,
- Aumento da permeabilidade da mucosa,
- Disfunção das defesas imunológicas locais.
Uma vez no líquido de ascite, as bactérias encontram um meio pobre em proteínas e complemento, com baixa capacidade opsônica, o que favorece sua sobrevivência e multiplicação. A presença de PAMPs ativa receptores de reconhecimento padrão (pattern-recognition receptors, como TLR4) nas células de Kupffer e nos macrófagos peritoneais, deflagrando uma resposta inflamatória sistêmica. Essa ativação leva à liberação de citocinas (IL-6, IL-8, TNF-α) e de óxido nítrico, o que amplia a vasodilatação esplâncnica e contribui para a disfunção circulatória característica da cirrose avançada.
Disfunção imunológica na cirrose
O paciente cirrótico apresenta uma síndrome conhecida como “disfunção imune associada à cirrose” (CAID – Cirrhosis-Associated Immune Dysfunction), que combina imunodeficiência e hiper-reatividade inflamatória.
Entre os mecanismos principais:
- Redução da fagocitose e da atividade opsônica no líquido de ascite (complemento e IgG baixos);
- Quimiotaxia e função bactericida de neutrófilos e macrófagos deprimidas;
- Diminuição da produção de proteínas do sistema complemento hepático (C3, C4, CH50);
- Diminuição da apresentação de antígenos e da ativação de linfócitos T;
- Produção cronicamente elevada de citocinas inflamatórias, levando à “paralisia imunológica” nos estágios avançados.
Essas alterações explicam por que, mesmo sem perfuração intestinal, o líquido ascítico se torna altamente suscetível à infecção espontânea. Além disso, o baixo teor proteico do líquido de ascite (< 1,5 g/dL) correlaciona-se diretamente com risco aumentado de PBE, pois reflete a depleção de proteínas opsônicas e complemento. (Fernández et al., Hepatology 2007)
Interação entre inflamação, hemodinâmica e função hepática
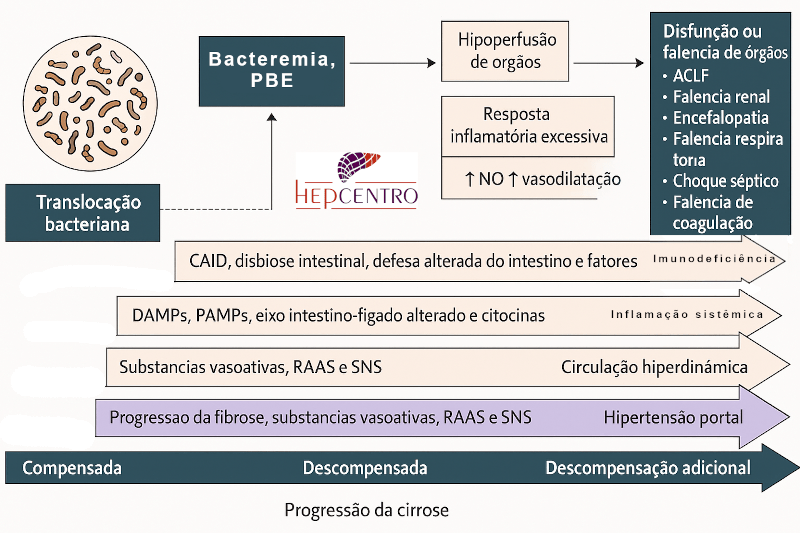
A infecção ascítica, por sua vez, retroalimenta a inflamação sistêmica, exacerbando a vasodilatação esplâncnica, reduzindo o volume circulante efetivo e precipitando síndrome hepatorrenal e encefalopatia hepática. A inflamação sustentada induz apoptose hepatocelular, disfunção mitocondrial e ativação de células estreladas, acelerando a progressão da fibrose e da própria cirrose.
Dessa forma, a PBE não é apenas uma complicação infecciosa, mas também um evento fisiopatológico que amplifica a falência multiorgânica da cirrose.
Em pessoas com cirrose, o intestino perde parte de sua barreira natural e deixa passar bactérias microscópicas para dentro do corpo. Como o fígado e o sistema de defesa estão enfraquecidos, essas bactérias acabam chegando ao líquido acumulado na barriga (ascite) e causam uma infecção grave, mesmo sem haver “ferida” ou perfuração. É o que chamamos de peritonite bacteriana espontânea.
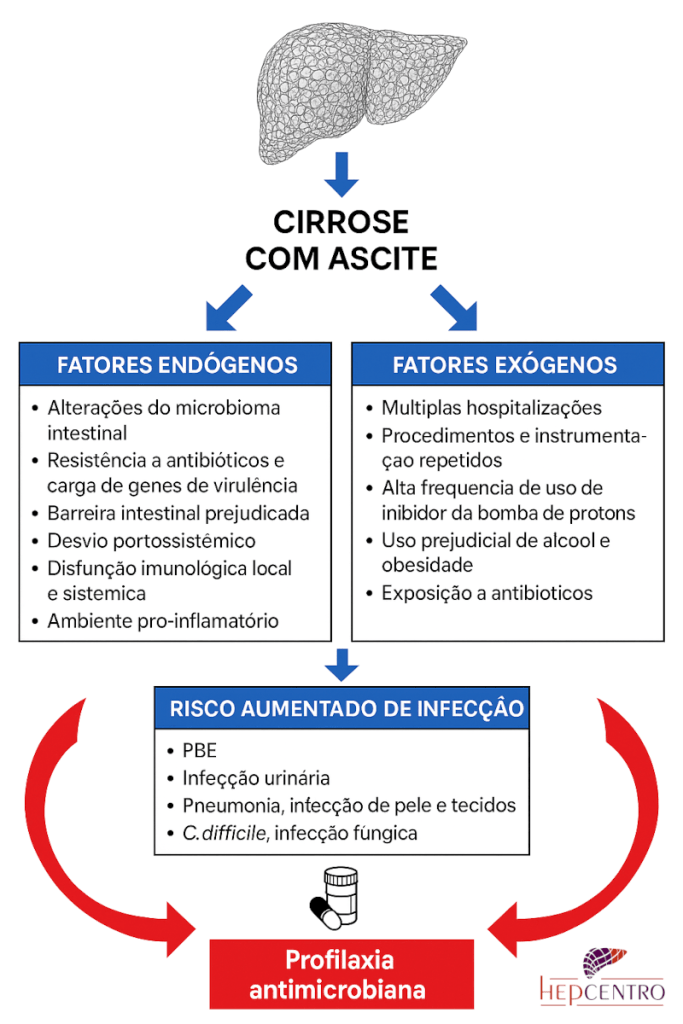
EPIDEMIOLOGIA E FATORES DE RISCO
A prevalência da PBE depende do cenário clínico: entre pacientes ambulatoriais com ascite compensada, a incidência anual é inferior a 3%, enquanto em pacientes hospitalizados por descompensação hepática, ela pode atingir de 10 a 30%. Nos casos de cirrose descompensada com ascite refratária, a taxa é ainda maior, chegando a 40% em algumas séries. Estudos também mostram que a mortalidade intra-hospitalar da PBE pode variar entre 20 e 40%, dependendo da resposta terapêutica e da presença de disfunção renal associada.
Os fatores de risco mais bem documentados incluem:
- Baixa concentração proteica no líquido de ascite (< 1,5 g/dL), que reduz a atividade opsônica e a defesa bacteriana local;
- Hiperbilirrubinemia (bilirrubina sérica > 3 mg/dL), como marcador de disfunção hepatocelular grave;
- Insuficiência renal ou elevação de creatinina (> 1,2 mg/dL), indicando risco aumentado de síndrome hepatorrenal;
- Hiponatremia (< 130 mEq/L), que reflete a ativação de sistemas neuro-hormonais e má perfusão circulatória;
- Hemorragia digestiva alta varicosa, que favorece translocação bacteriana e bacteremia;
- Classificação Child-Pugh C ou MELD elevado, como marcadores de gravidade da cirrose;
- Episódio prévio de PBE, com risco de recorrência anual superior a 70% sem profilaxia antibiótica;
- Internação hospitalar prévia ou uso recente de antibióticos, que aumenta a chance de infecção por bactérias multirresistentes.
Alguns fatores aumentam o risco de peritonite. Quanto mais avançada a doença do fígado, maior o risco. Esse risco aumenta muito após episódios de hemorragia por varizes esofágicas.
Além desses, outros fatores emergentes têm sido reconhecidos: uso de inibidores da bomba de prótons (que alteram o microbioma intestinal), disbiose intestinal associada à cirrose e internações repetidas que favorecem colonização por enterobactérias resistentes.
DIAGNÓSTICO
Indicação de paracentese:
- Toda vez que um paciente com ascite é internado, recomenda-se realização de paracentese diagnóstica imediatamente (exceto em contra-indicação evidente) para excluir PBE. A AASLD enfatiza que até 13 % dos casos de PBE podem ser assintomáticos.
- Além disso, deve-se suspeitar de PBE se houver febre, dor abdominal, encefalopatia aguda, insuficiência renal, piora da função hepática, ou mesmo sem sintomas específicos.
Leia mais sobre paracentese.
Exames no líquido de ascite devem incluir:
- Contagem celular com diferencial (neutrófilos/PMN).
- Cultura e Gram do líquido: idealmente semear o material colhido imediatamente em frasco de hemocultura.
Critério diagnóstico usual: PMN ≥ 250 células/mm³ → tratar como PBE. Mesmo que a cultura seja negativa, se o PMN estiver acima desse limiar e não haja foco secundário, considera-se “neutrocítica sem cultura positiva” e trata-se como PBE.
Se a cultura for positiva com contagem de PMN < 250 e sem sintomas, pode ser “bacterascite” — não necessariamente requer tratamento imediato, mas deve ser monitorado.
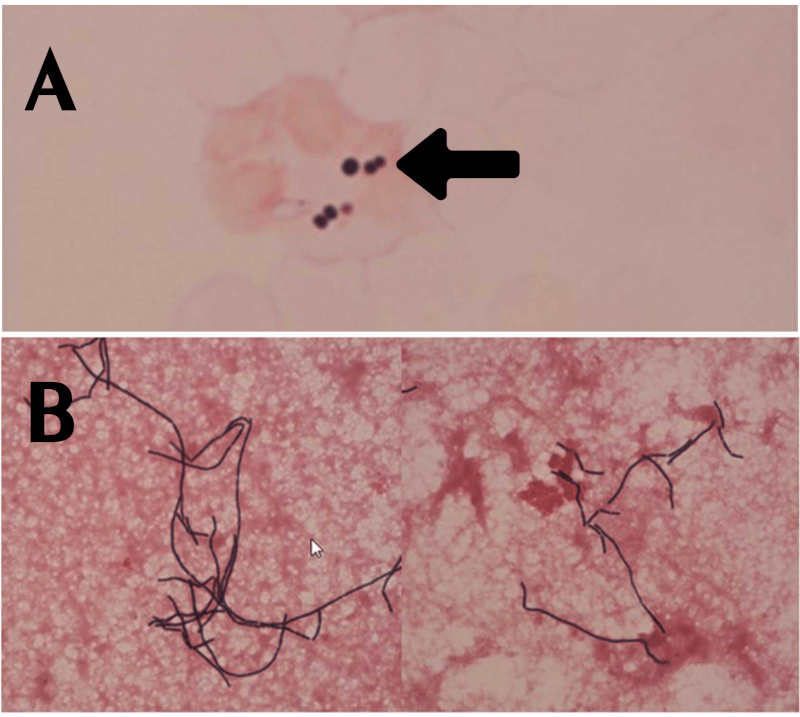
Citopatologia
- É importante diferenciar PBE de peritonite secundária (ex.: perfuração intestinal) — esta última apresenta contagem elevada de neutrófilos, cultura policlonal, e achados de foco intra-abdominal evidente.
EVOLUÇÃO DOS AGENTES INFECCIOSOS
| Período / Cenário | Bactérias mais comuns | Comentários principais |
| 1970–início 1990 – séries clássicas | Gram-negativos entéricos: E. coli, Klebsiella spp.; Gram-positivos: Streptococcus spp. | PBE típica comunitária, monomicrobiana; pouca resistência; 3ª geração de cefalosporinas altamente eficaz. |
| Final 1990–2000 | E. coli ainda principal; aumento de Klebsiella e outros G−; G+ ainda <25% na maioria das séries | Começam a surgir relatos de resistência (quinolonas, algumas cefalosporinas), mas padrão ainda dominado por enterobactérias sensíveis. |
| ~1998–2014 – meta-séries contemporâneas (internados) | Mistura de G− e G+; G−: E. coli (ainda líder), Klebsiella spp.; G+: Streptococcus spp., Enterococcus spp., Staphylococcus spp. | Aumenta fortemente participação de cocos G+ (alguns relacionados a procedimentos e profilaxia crônica); início de destaque para ESBL, MRSA, VRE em PBE nosocomial. |
| 2010–2019 – era da resistência e PBE nosocomial | Comunitária: ainda predomínio de E. coli e enterobactérias. Nosocomial/healthcare: mais G+ (Enterococcus, Staph), ESBL, Pseudomonas. | Seleção por uso de quinolonas e cefalosporinas e aumento de procedimentos invasivos → necessidade de distinguir PBE comunitária vs nosocomial na escolha empírica. |
| 2020–2024 – cenário atual (variação regional importante) | Mantidos E. coli e Klebsiella spp. como agentes-chave; alta proporção de cocos G+ (streptococos, enterococos, estafilococos); crescimento de ESBL, carbapenem-resistentes e VRE. | Reforça a recomendação de adequar antibioticoterapia empírica ao perfil local: 3ª geração ainda opção para comunitária; para nosocomial/alto risco → pip/tazo, carbapenêmicos ± cobertura para G+. |
TRATAMENTO
O tratamento da peritonite bacteriana espontânea (PBE) deve ser iniciado imediatamente após a paracentese diagnóstica após o resultado da contagem celular, antes mesmo dos resultados da cultura, pois a demora terapêutica está associada a aumento significativo da mortalidade. As metas principais são: erradicar a infecção, prevenir a síndrome hepatorrenal e minimizar descompensações adicionais da cirrose.
Antibióticos empíricos
A escolha inicial do antibiótico deve basear-se no cenário clínico (comunitário ou hospitalar) e no perfil epidemiológico local de resistência bacteriana.
- PBE comunitária:
- Cefotaxima 2 g IV a cada 8 horas ou ceftriaxona 2 g IV 1x/dia são os fármacos de escolha clássicos.
- Esses esquemas permanecem altamente eficazes em ambientes com baixa prevalência de cepas multirresistentes (MDR), como E. coli e Klebsiella spp. não produtoras de ESBL.
- A duração habitual é de 5 a 7 dias (podendo estender até 10–14 dias em casos complicados).
- PBE nosocomial ou associada à assistência à saúde:
- Nestes casos, há maior probabilidade de infecção por bactérias produtoras de ESBL, Pseudomonas aeruginosa, Enterococcus spp. e Staphylococcus aureus resistente à meticilina (MRSA).
- As diretrizes AASLD e EASL recomendam iniciar antibióticos de espectro ampliado, como:
- Piperacilina-tazobactam 4,5 g IV a cada 6–8 horas, ou
- Carbapenêmico (ex.: meropenem 1 g IV a cada 8 horas) em locais com alta prevalência de ESBL/CRE,
- Considerar associação com glicopeptídeo (vancomicina) ou linezolida quando houver risco de MRSA ou Enterococcus resistente.
- Após melhora clínica e disponibilidade dos resultados de cultura, recomenda-se descalonamento para um regime mais restrito, de acordo com o antibiograma.

- Alternativas terapêuticas:
- Amoxicilina/ácido clavulânico IV e fluoroquinolonas (ciprofloxacina, levofloxacina) podem ser opções em locais de baixa resistência, mas seu uso empírico é cada vez menos recomendado devido à disseminação de cepas resistentes.
- Em casos de alergia grave à penicilina, considerar aztreonam + glicopeptídeo, embora essa associação cubra parcialmente Gram-positivos.
PBE comunitária vs nosocomial e sugestão de esquema empírico
Baseado em AASLD 2021, EASL, Piano 2016 e dados recentes de resistência bacteriana. Deve sempre ser ajustado ao perfil microbiológico local.
| Tipo de PBE | Perfil bacteriano típico (tendência) | Esquema empírico sugerido* | Observações |
| Comunitária | Tradicionalmente dominada por Gram-negativos entéricos: Escherichia coli (incluindo não-ESBL), Klebsiella spp.; Streptococcus spp. ainda relevantes; menor proporção de MDR. | Cefotaxima 2 g IV 8/8 h ou ceftriaxona 2 g IV 1x/dia, por 5–7 dias. Adicionar albumina (1,5 g/kg D1 + 1 g/kg D3) nos casos com creatinina elevada, bilirrubina alta ou gravidade clínica. Reavaliar em 48 h. | Baseado em AASLD 2021 e EASL 2010. Cefalosporinas de 3ª geração continuam adequadas em locais com baixa prevalência de ESBL. |
| Nosocomial | Maior frequência de Gram-positivos (Enterococcus spp., Staphylococcus spp. incluindo MRSA) e Gram-negativos MDR (ESBL, Pseudomonas, CRE). Taxa global de MDR em cirróticos hospitalizados ~30–35%. | Piperacilina-tazobactam IV ou carbapenêmico (ex.: meropenem) em áreas com alta prevalência de ESBL/CRE; considerar adicionar glicopeptídeo (vancomicina/linezolida) se suspeita de MRSA/Enterococcus resistente. Duração 5–7 dias. | Baseado em Piano 2016 e AASLD/EASL 2021. Revisar resposta clínica e cultura; ajustar antibiótico conforme perfil local; sempre excluir peritonite secundária se ausência de resposta. |
*As doses devem ser ajustadas à função renal e protocolos institucionais. Fontes: Biggins et al., Hepatology 2021 (AASLD); EASL J Hepatol 2010; Piano S et al., Hepatology 2016; Dever JB 2015; Alfieri A 2024.
Albumina
A albumina intravenosa é parte essencial do tratamento da PBE, por prevenir insuficiência renal e reduzir mortalidade. O esquema clássico (Sort et al., NEJM 1999) é:
- Dia 1: 1,5 g/kg de albumina IV
- Dia 3: 1,0 g/kg de albumina IV
O benefício é mais expressivo em pacientes com creatinina > 1 mg/dL, bilirrubina > 4 mg/dL, ou ureia > 30 mg/dL.
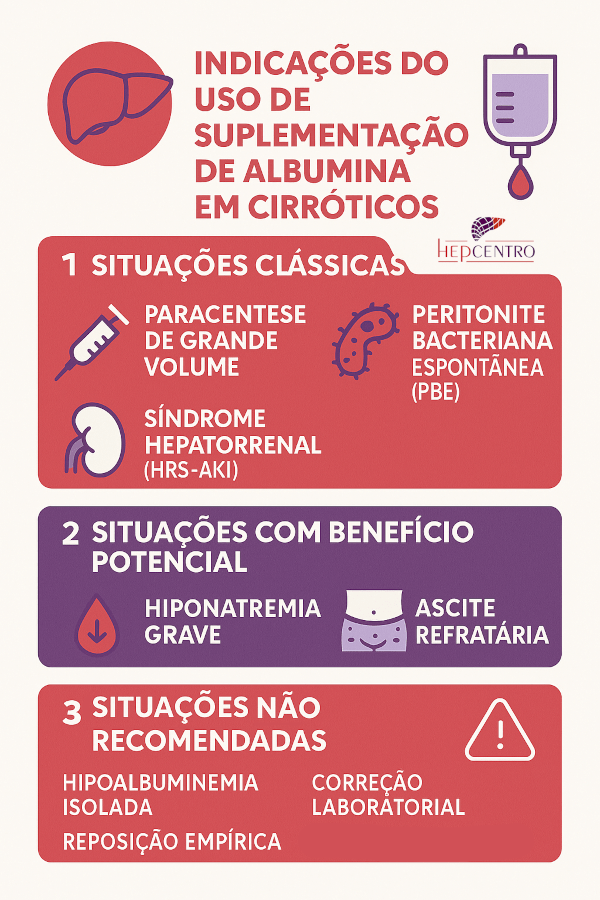
A albumina melhora o volume circulante efetivo, reduz a ativação do sistema renina-angiotensina-aldosterona e reduz o risco de síndrome hepatorrenal tipo 1. Estudos subsequentes confirmaram sua eficácia mesmo em pacientes de risco intermediário e, embora o custo disso seja considerado alto, a relação custo/benefício (em termos de custos de tratar as complicações) é adequada.
Suporte clínico e medidas complementares
O manejo da PBE deve ser acompanhado de uma série de medidas de suporte:
- Suspensão imediata de diuréticos (espironolactona, furosemida) durante a fase aguda, pois aumentam o risco de hipovolemia e insuficiência renal;
- Restrição de líquidos e sódio conforme o grau de ascite e função renal;
- Correção de distúrbios hidroeletrolíticos, especialmente hiponatremia e hipocalemia;
- Controle rigoroso da função renal e hemodinâmica, com monitorização de diurese e creatinina diária;
- Evitar fármacos nefrotóxicos, como AINEs, aminoglicosídeos e contraste iodado;
- Profilaxia de encefalopatia hepática com lactulose, se houver alteração de consciência;
- Nutrição adequada, com suporte proteico conforme tolerância hepática.
Monitorização e reavaliação
Após 48 horas de tratamento:
- Repetir a paracentese diagnóstica se o paciente não apresentar melhora clínica evidente.
- A contagem de PMN deve cair pelo menos 25% em relação à inicial; caso contrário, considerar:
- peritonite secundária (perfuração intestinal, abscesso, apendicite, etc.);
- infecção por cepa multirresistente.
- Se a cultura inicial for negativa mas o paciente respondeu bem, manter antibiótico até completar o curso usual (5–7 dias).
A alta hospitalar pode ser considerada quando o paciente estiver afebril, com função renal estável e regressão da ascite sintomática. É essencial iniciar ou revisar profilaxia secundária antes da alta (norfloxacina ou equivalente).
PROFILAXIA
A profilaxia da PBE tem papel fundamental na prevenção de novos episódios e na redução da mortalidade em pacientes com cirrose e ascite. Ela deve ser individualizada, considerando o risco de PBE primária (prevenção do primeiro episódio) e o risco de recorrência (profilaxia secundária).
As recomendações atuais baseiam-se em três cenários principais:
Profilaxia durante hemorragia digestiva alta varicosa
Todo paciente com cirrose que apresenta sangramento de varizes esofágicas ou gástricas deve receber antibiótico profilático desde a admissão hospitalar. O objetivo é prevenir infecções bacterianas (PBE, bacteremia, pneumonia e ITU), que ocorrem em até 45% dos casos sem profilaxia.
A ceftriaxona 1 g IV a cada 24 h por até 7 dias é o esquema de escolha, especialmente em hospitais com alta prevalência de resistência a quinolonas. Alternativamente, pode-se utilizar norfloxacina 400 mg VO 2x/dia por 7 dias em locais com baixa taxa de microrganismos multirresistentes (MDR).
A profilaxia reduz em cerca de 80% o risco de PBE e melhora a sobrevida hospitalar (Bernard et al., NEJM 1999; AASLD 2021).
Nota clínica: Após o controle da hemorragia, o antibiótico deve ser suspenso, evitando prolongar o uso desnecessariamente.
Profilaxia primária em pacientes de alto risco
Pacientes com ascite de baixo teor proteico (< 1,5 g/dL) e pelo menos um dos seguintes critérios apresentam alto risco de PBE e devem ser considerados para profilaxia contínua:
- Insuficiência renal (creatinina > 1,2 mg/dL ou ureia > 25 mg/dL);
- Plaquetopenia < 100.000/mm3
- Hiponatremia (< 130 mEq/L);
- Escore Child-Pugh ≥ 9 com bilirrubina ≥ 3 mg/dL
Nesses pacientes, a profilaxia reduz significativamente o risco de primeiro episódio de PBE e melhora a sobrevida em estudos randomizados (Ginés et al., Gastroenterology 1990; Fernández et al., Hepatology 2007).
Os esquemas mais utilizados são:
- Norfloxacina 400 mg VO 1x/dia;
- Alternativas: ciprofloxacina 500 mg VO 1x/dia ou trimetoprim-sulfametoxazol 160/800 mg VO 5x/semana.
Deve-se reavaliar periodicamente a necessidade de manutenção, já que a profilaxia prolongada pode alterar a microbiota intestinal e favorecer o surgimento de cepas resistentes (Enterococcus spp., Staphylococcus spp., Pseudomonas spp.).
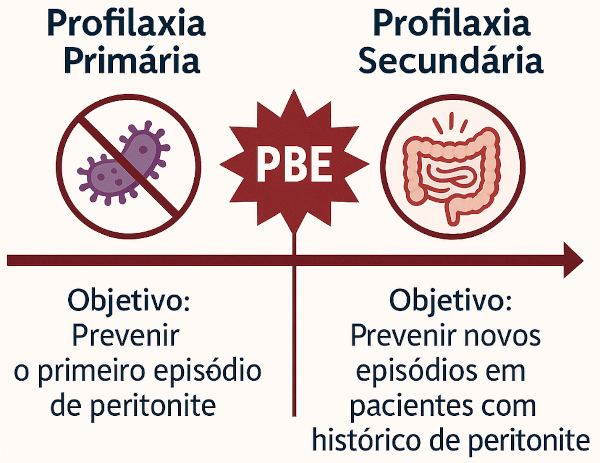
Profilaxia secundária
Após o primeiro episódio confirmado de PBE, o risco de recorrência em 1 ano sem profilaxia é de 40 a 70%, com mortalidade superior a 50%. Assim, todos os pacientes que sobreviverem a um episódio devem receber profilaxia antibiótica até o transplante hepático ou resolução da ascite.
Os esquemas recomendados são idênticos aos da profilaxia primária:
- Norfloxacina 400 mg VO 1x/dia (preferencial),
- Alternativas: ciprofloxacina 500 mg VO 1x/dia ou trimetoprim-sulfametoxazol 160/800 mg VO 5x/semana.
Estudos demonstram redução significativa de novos episódios e melhora na sobrevida global (Fernández et al., Hepatology 2007).
Atenção: Pacientes com uso prolongado (> 6 meses) devem ser monitorados quanto ao surgimento de bactérias resistentes e efeitos adversos gastrointestinais.
| Situação clínica | Tipo de profilaxia | Antibiótico recomendado | Duração |
|---|---|---|---|
| Hemorragia digestiva varicosa | Curta (7 dias) | Ceftriaxona 1 g IV/dia (ou norfloxacina 400 mg VO 2x/dia) | Durante o episódio de sangramento |
| Ascite com proteína < 1,5 g/dL + fatores de risco (bilirrubina, insuf. renal, Child C) | Primária (contínua) | Norfloxacina 400 mg VO 1x/dia | Indefinida – revisar periodicamente |
| Após episódio prévio de PBE | Secundária (contínua) | Norfloxacina 400 mg VO 1x/dia ou TMP-SMX 5x/semana | Até transplante ou resolução da ascite |
PROGNÓSTICO E COMPLICAÇÕES
A PBE representa um marco de descompensação avançada da cirrose, sendo um forte preditor de mortalidade a curto e médio prazo. Estudos multicêntricos indicam mortalidade intra-hospitalar entre 20 e 40%, dependendo da gravidade clínica e da resposta ao tratamento. Mesmo entre os sobreviventes do episódio agudo, a sobrevida global em um ano raramente ultrapassa 50%, sobretudo nos pacientes com disfunção renal ou escore MELD elevado.
A PBE pode precipitar ou agravar múltiplas complicações da cirrose, sendo a síndrome hepatorrenal (SHR) a mais temida. A inflamação sistêmica desencadeada pela infecção induz vasodilatação esplâncnica, ativação neuro-hormonal e hipoperfusão renal, levando à insuficiência renal funcional — SHR tipo 1 (aguda, rapidamente progressiva) ou tipo 2 (subaguda, associada à ascite refratária). O risco de SHR após um episódio de PBE é estimado entre 30 e 40%. O uso precoce de albumina intravenosa (1,5 g/kg no dia 1 + 1 g/kg no dia 3) demonstrou reduzir significativamente a incidência de SHR e melhorar a sobrevida (Sort et al., NEJM 1999).
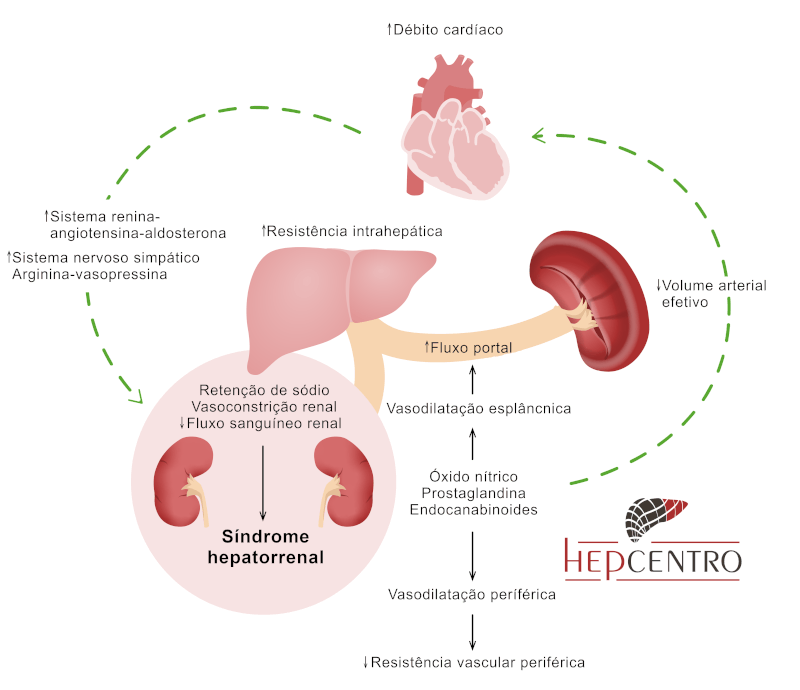
Além da SHR, outras complicações frequentes incluem:
- Encefalopatia hepática, pela exacerbação da inflamação e do metabolismo de amônia;
- Síndrome da resposta inflamatória sistêmica (SIRS) e choque séptico, quando há liberação intensa de citocinas pró-inflamatórias;
- Falência hepática aguda-sobre-crônica (ACLF), quadro de rápida deterioração hepática acompanhada de disfunção de múltiplos órgãos;
- Recorrência de PBE, que ocorre em até 70% dos casos dentro de um ano sem profilaxia antibiótica adequada;
- Infecções secundárias ou coinfecções, como pneumonia, ITU e bacteremia, que elevam a mortalidade total.
Os principais fatores prognósticos adversos incluem:
- Bilirrubina sérica > 3 mg/dL;
- Creatinina sérica > 1,5 mg/dL ou aumento > 50% do basal;
- Pressão arterial média < 70 mmHg;
- Escore MELD > 22 ou Child-Pugh C;
- Falha de resposta ao antibiótico empírico inicial;
- Isolamento de microrganismos multirresistentes (MDR), como cepas produtoras de ESBL, Pseudomonas aeruginosa resistente a carbapenêmicos ou Enterococcus resistente à vancomicina (VRE);
- Episódio recorrente de PBE ou coexistência de ascite refratária.
Do ponto de vista prognóstico, um episódio de PBE deve ser interpretado como sinal de falência hepática iminente. As diretrizes da AASLD e da EASL enfatizam que todo paciente com cirrose que desenvolve PBE deve ser avaliado para transplante hepático, exceto se houver contraindicação formal.
Além da terapia antibiótica e da albumina, o manejo pós-infecção deve incluir profilaxia secundária, controle rigoroso da ascite, tratamento de encefalopatia e monitoramento renal intensivo. O seguimento clínico-laboratorial nas semanas subsequentes é crucial para detectar recaídas, ajustar diuréticos e planejar o encaminhamento a centro transplantador.
PONTOS PRÁTICOS PARA CLÍNICOS
- Em todo paciente com ascite novo ou internado: paracentese sem demora.
- Se PMN ≥ 250 cél/mm³, assumir PBE e iniciar tratamento – não aguardar cultura.
- Administrar albumina especialmente nos casos com função renal alterada ou bilirrubina elevada.
- Ajustar antibiótico conforme perfil local e evolução clínica.
- Em caso de piora ou ausência de resposta, investigar peritonite secundária (exame de imagem, cirurgia).
- Atentar à profilaxia em grupos de risco, mas pesar riscos/benefícios em face de resistência microbiana.
- Avaliar função hepática global, possibilidade de transplante, e manejo da ascite (restrição de sódio, diuréticos, paracentese periódica) como parte da estratégia global.
- Educar o paciente e equipe sobre sinais de alerta: febre, dor abdominal, piora da ascite, alteração do nível de consciência — todo paciente com cirrose + ascite sabe que a “água na barriga” pode ficar infectada.
CONSIDERAÇÕES ESPECIAIS PARA ESPECIALISTAS
- O perfil microbiano da PBE vem mudando: além de bactérias Gram-negativas clássicas (Escherichia coli, Klebsiella), há aumento de Gram-positivos e organismos resistentes.
- A decisão de usar profilaxia contínua deve ser ponderada à luz de risco de multirresistência e ecologia local – a revisão recente alerta que “menos é mais” em alguns casos.
- A albumina deve ser usada conforme evidência, mas ainda há discussão sobre doses e perfis de pacientes que mais se beneficiam.
- Em centros com alta prevalência de bactérias multirresistentes ou PBE hospitalar, o regime empírico pode diferir do padrão clássico, exigindo antibiograma.
- A integração com estratégias de transplante hepático, manejo de ascite refratária, suporte multidisciplinar (nutrição, fisioterapia, farmacovigilância, enfermagem) e vigilância de infecções associadas (ex: pneumonia, UTI, bactérias resistentes) é essencial.
CONCLUSÃO
A peritonite bacteriana espontânea permanece uma das complicações mais graves da ascite em cirrose. O reconhecimento precoce, a intervenção imediata com antibiótico + albumina, e a integração com o manejo global da cirrose são fundamentais para melhorar os resultados. As diretrizes da AASLD e EASL oferecem bases claras para diagnóstico, tratamento e profilaxia, embora a prática clínica precise sempre considerar o perfil local de microbiologia, risco individual de resistência e evolução clínica. Em paralelo, a educação do paciente e a vigilância ativa são componentes imprescindíveis na rotina de hepatologia. Para o médico generalista, a mensagem chave é: em paciente com ascite, toda internação exige pensamento imediato em PBE; e para o especialista, a personalização do tratamento segundo perfil local e paciente é a fronteira atual.
BIBLIOGRAFIA
- BIGGINS, Scott W. et al. Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, v. 74, n. 2, 2021. Disponível em: https://ptg-e.org.pl/wp-content/uploads/2022/03/4_SBPHRS_AASLD_CPG_Hepatology_2021.pdf.
- EUROPEAN ASSOCIATION FOR THE STUDY OF THE LIVER. EASL Clinical Practice Guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. Journal of Hepatology, v. 53, n. 3, 2010. Disponível em: https://easl.eu/wp-content/uploads/2018/10/decompensated-cirrhosis-English-report.pdf. Acesso em: 8 nov. 2025.
- RUNYON, Bruce A. Management of Adult Patients With Ascites Due to Cirrhosis: Update 2012. Hepatology, v. 57, n. 4, 2013.
- DANANI, Muhammad et al. Prophylaxis against spontaneous bacterial peritonitis (SBP): Too much or too little? Frontiers in Medicine, 2022. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9726478/. Acesso em: 8 nov. 2025.
- MEDSCAPE. Spontaneous Bacterial Peritonitis (SBP) Treatment & Management. Disponível em: https://emedicine.medscape.com/article/789105-treatment. Acesso em: 8 nov. 2025.
- Maccauro V, Airola C, Santopaolo F, Gasbarrini A, Ponziani FR, Pompili M. Gut Microbiota and Infectious Complications in Advanced Chronic Liver Disease: Focus on Spontaneous Bacterial Peritonitis. Life. 2023; 13(4):991. https://doi.org/10.3390/life13040991
- DEVER, John B.; SHELLMAN, Bradley M. Spontaneous bacterial peritonitis – bacteriology, diagnosis, treatment, risk factors and prevention. Alimentary Pharmacology & Therapeutics, v. 41, n. 11, p. 1116-1131, 2015. DOI: 10.1111/apt.13172.
- PIANO, Stefano; BROGGINI, Luigi; ANGELONI, Silvia et al. Epidemiology and management of bacterial infections in cirrhosis. Gastroenterology, v. 157, n. 1, p. 206-222.e2, 2019. DOI: 10.1053/j.gastro.2019.03.048.
- ALFIERI, Andrea; KUBASTA, Anastasia; HERNANDEZ, Luis A. Current trends in spontaneous bacterial peritonitis: resistance patterns and prevention strategies. Signa Vitae, v. 20, n. 1, p. 45-54, 2024. DOI: 10.22514/sv2024.004.
- BERNARD, Benoît; GRANGÉ, Jean-Daniel; KHAC, Erick N. et al. Antibiotic prophylaxis for bacterial infections in cirrhotic patients with gastrointestinal bleeding: a randomized, double-blind, controlled trial. The New England Journal of Medicine, v. 341, n. 25, p. 1639-1645, 1999. DOI: 10.1056/NEJM199912163412502.
- GINÉS, Pere; URIZ, Juana; CALAHORRA, Beatriz et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a randomized controlled trial. Gastroenterology, v. 99, n. 2, p. 590-595, 1990. DOI: 10.1016/0016-5085(90)91036-E.
- FERNÁNDEZ, Javier; NAVASA, Mireia; PLANAS, Ricard et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorenal syndrome and improves survival in cirrhosis. Hepatology, v. 45, n. 3, p. 939-948, 2007. DOI: 10.1002/hep.21606.
- SORT, Pere; NAVASA, Mireia; ARROYO, Vicente et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. The New England Journal of Medicine, v. 341, n. 6, p. 403-409, 1999. DOI: 10.1056/NEJM199908053410603.
- FERNÁNDEZ, Javier; ACEVEDO, Juan; CASTELLVÍ, Josep M. et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology, v. 55, n. 3, p. 982-990, 2012. DOI: 10.1002/hep.24790.
- PACHE, Inês; RIBEIRO, Mariana; SILVA, Filipa et al. Multidrug-resistant bacteria in spontaneous bacterial peritonitis: clinical features and outcomes. World Journal of Hepatology, v. 14, n. 5, p. 975-989, 2022. DOI: 10.4254/wjh.v14.i5.975.
- ALBILLOS, Agustín; LAPENA, José M.; MOLINA, Antonio M. et al. Infection and inflammation in cirrhosis: current concepts and future directions. Journal of Hepatology, v. 73, n. 1, p. 139-148, 2020. DOI: 10.1016/j.jhep.2020.01.007.
- Joseph Tholany, Hasan Samra, Takaaki Kobayashi, Kunatum Prasidthrathsint, Primary spontaneous listerial peritonitis, IDCases, Volume 32, 2023, e01748, ISSN 2214-2509, https://doi.org/10.1016/j.idcr.2023.e01748.
- Boregowda U, Umapathy C, Halim N, Desai M, Nanjappa A, Arekapudi S, Theethira T, Wong H, Roytman M, Saligram S. Update on the management of gastrointestinal varices. World J Gastrointest Pharmacol Ther 2019; 10(1): 1-21 [PMID: 30697445 DOI: 10.4292/wjgpt.v10.i1.1]
- Piano S, Bunchorntavakul C, Marciano S, Rajender Reddy K. Infections in cirrhosis. Lancet Gastroenterol Hepatol. 2024 Aug;9(8):745-757. doi: 10.1016/S2468-1253(24)00078-5. Epub 2024 May 13. PMID: 38754453.
Artigo criado em: 08/02/2023
Última atualização: 13/11/2025

